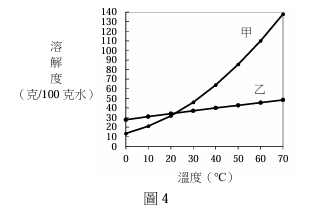
<單選題>文強在不同溫度下測定 KNO₃和 KCl對水的溶解度(克/100克水),他將數據記錄於表 3,並據以繪製圖 4表達溶解度與溫度的關係。
表3
| 溫度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| KNO₃(克) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl(克) | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
下列關於此實驗的結論及其後續實驗的敘述,何者正確?
(A)圖4的曲線甲為KCl的溶解度與溫度的關係
(B)由圖4得知 KNO₃和KCl在某一溫度時具有相同的溶解度 x,且36.0<x<37.0
(C)10℃時,131克飽和KCl溶液加熱蒸發10克水後,再降溫到10℃,充分攪拌該溶液待其達平衡後,則此時溶液的重量百分濃度為25%
(D) 20℃時,將裝有5毫升飽和 KNO₃溶液的試管,置於裝有100毫升水的燒杯中,並於燒杯中加入10克 KNO₃固體,充分攪拌待其溶解後,則可見到試管中有結晶析出
(E)已知一混合物中含有等重量的 KNO₃和KCl,文強根據他的實驗結果,可利用加熱蒸發濃縮、冷卻結晶、過濾的方法將兩者分離
答案