<多選題>乙醇在高溫(>500 K)下,於氧化鋁的表面上會進行以下的反應:
\[ C_2H_5OH(g) \rightarrow C_2H_4(g) + H_2O(g) \]
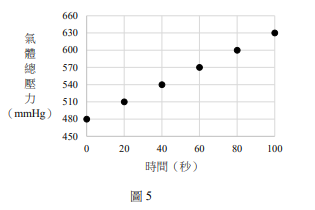
若於一密閉容器中進行此反應,在不同的時間所量得容器內的氣體總壓力如圖5所示。
下列哪些敘述正確?
(A)此為一級反應
(B)乙醇的量減少至原來的一半時,需時160秒
(C)此反應的速率常數為15 mm Hg/秒
(D)第40秒時,\( C_2H_4 \) 的生成速率為1.5 mm Hg/秒
(E)反應時間為50秒時,乙醇的分壓為405 mmHg
答案