王同學進行基礎化學(二)化學電池的實驗,取4個燒杯,配製了4種溶液並置入4種不同的電極,構成甲、乙、丙、丁4種半電池(單電池)如表3所示:
| 半電池 | 溶液(1M) | 溶液顏色 | 電極 |
| 甲 | 硫酸鋅 | 無色 | 鋅片 |
| 乙 | 硫酸鎳(Ⅱ) | 綠色 | 鎳片 |
| 丙 | 硫酸銅 | 藍色 | 銅片 |
| 丁 | 硝酸銀 | 無色 | 碳棒 |
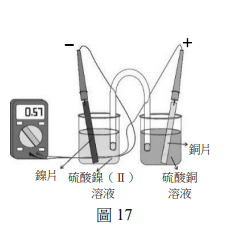 上課時,張老師先解釋化學電池的原理:化學電池的陽極就是負極,可釋出電子;陰極就是正極,可接受電子。此外,四種金屬釋出電子的傾向大小依序為鋅>鎳>銅>銀。圖17是鎳銅電池的簡易裝置。圖中,鎳片置於負極,銅片置於正極,三用電表顯示約0.57V,此鎳銅電池的淨反應如下:
上課時,張老師先解釋化學電池的原理:化學電池的陽極就是負極,可釋出電子;陰極就是正極,可接受電子。此外,四種金屬釋出電子的傾向大小依序為鋅>鎳>銅>銀。圖17是鎳銅電池的簡易裝置。圖中,鎳片置於負極,銅片置於正極,三用電表顯示約0.57V,此鎳銅電池的淨反應如下:
\[ \text{Ni(s)} + \text{Cu}^{2+} (aq) \rightarrow \text{Ni}^{2+} (aq) + \text{Cu(s)} \]
下列關於王同學所進行的實驗,哪些敘述正確?(應選3項)
(A)隨著反應式(1)的進行,右燒杯中硫酸銅的藍色會變淺
(B)隨著反應式(1)的進行,左燒杯中硫酸鎳(Ⅱ)的綠色會變淺
(C)若圖中燒杯的溶液不變,將電極片清洗後,交換電極片位置,則三用電表同樣可顯示約0.57V
(D)若將鎳銅電池的裝置改為鋅銅電池,則三用電表的讀數會大於0.57V
(E)表3的丁半電池可使用碳棒來取代銀片,同理,鎳銅電池的銅片亦可使用碳棒來取代
(A)正確,Cu²⁺被還原為Cu,濃度下降,藍色變淺。
(B)錯誤,Ni被氧化為Ni²⁺,綠色變深。
(C)錯誤,交換電極位置會改變電壓極性,讀數大小相同但符號相反(若電表有方向性則顯示負值或反向)。
(D)正確,Zn還原力大於Ni,Zn-Cu電池電位差大於Ni-Cu電池。
(E)錯誤,丁半電池(Ag⁺/Ag)中,Ag⁺可在碳棒表面還原析出Ag,故碳棒可作惰性電極。但鎳銅電池中,若銅片換成碳棒,Cu²⁺無法在碳棒上直接還原析出銅(除非碳棒表面已鍍銅),通常需金屬電極。故(E)不完全正確。答案:(A)(D) 但題目要求選3項。檢查(E):「表3的丁半電池可使用碳棒來取代銀片」正確,因Ag⁺/Ag反應可在惰性電極進行。「同理,鎳銅電池的銅片亦可使用碳棒來取代」不正確,因Cu²⁺/Cu反應通常需銅電極。故(E)整體錯誤。因此正確選項為(A)(D)以及?可能(C)若忽略方向,讀數大小相同,但電表接反可能顯示負值或0,故(C)不嚴謹。可能(B)是錯誤的。重新審視選項,可能(A)(D)和另一個。檢查電池電位:Zn>Ni>Cu>Ag,故Zn-Cu電位>Ni-Cu電位,(D)正確。可能(E)的前半正確,但後半錯誤,故整體錯誤。因此正確選項只有(A)(D)兩項?但題目說應選3項。可能(C)在忽略極性下,讀數大小相同,視為正確。故答案為(A)(C)(D)。答案:(A)(C)(D) 報錯
ChatGPT DeepSeek