11. 某生配製濃度均為1.0 M的Pb(NO\(_3\))\(_2\)、H\(_2\)SO\(_4\)、BaCl\(_2\)與AgNO\(_3\)四種水溶液後,忘記標示,致使無法辨識各溶液。為能得知各溶液成分,他先將溶液標示為:甲、乙、丙、丁,再從中分別多次取出1.0 mL,兩兩混合,所得實驗結果記錄如下:
I. 甲與乙混合後會產生白色沉澱。甲與丙或丁混合,則無變化。
II. 乙與丙、丁混合時,皆會產生白色沉澱。若對乙與丁反應所得的產物加熱,則所得沉澱物會溶解。
III. 丙與丁混合時會產生白色沉澱,加熱後不會消失。
根據上述實驗結果,下列敘述哪些正確?
(A)甲為AgNO\(_3\)
(B)乙為H\(_2\)SO\(_4\)
(C)丙為BaCl\(_2\)
(D)丁為Pb(NO\(_3\))\(_2\)
(E)若於丁溶液中加入KI水溶液,則會產生沉澱
114分科化學
114分科化學考科-12
12. 某反應是一種振盪反應,反應溶液初始為紅色,經過一段時間後轉變為藍色,然後再轉變成紅色。溶液顏色就在紅與藍之間振盪,推測的反應步驟如下:
步驟甲:BrO₃⁻ + 2 Br⁻ + 3 CH₂(COOH)₂ + 3 H⁺ → 3 BrCH(COOH)₂ + 3 H₂O
步驟乙:BrO₃⁻ + 4 Fe(o-phen)₃²⁺ + 5 H⁺ ↔ HOBr + 4 Fe(o-phen)₃³⁺ + 2 H₂O(紅色) (藍色)
步驟丙:HOBr + 2 CH₂(COOH)₂ + 2 Fe(o-phen)₃³⁺ + BrCH(COOH)₂ + 2 H₂O ↔ 2 Fe(o-phen)₃²⁺ + 3 HOCH(COOH)₂ + 2 Br⁻ + 4H⁺
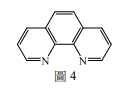
步驟甲中的溴離子濃度降低後,反應則切換至步驟乙,溶液顏色從紅色轉變為藍色。然後步驟丙中錯合物Fe(o-phen)₃³⁺與次溴酸及溴化丙二酸反應後,再生成溴離子,溶液顏色從藍色轉變成紅色。化學式中o-phen的結構如圖所示,為一雙牙基的配位子。下列關於此振盪反應的敘述,哪些正確?
(A)步驟甲中,溴酸根是還原劑
(B)Fe(o-phen)₃³⁺氧化後呈現紅色
(C)步驟乙中,溴酸根產生次溴酸是還原反應
(D)Fe(o-phen)₃²⁺中鐵離子的配位數是6
(E)步驟丙中溶液顏色變化是因為溴離子所造成
114分科化學考科-13
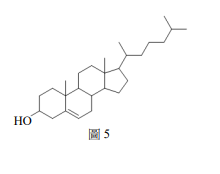
13. 膽固醇可由肝細胞合成或由食物中攝取,是人體中重要的成分。膽固醇的結構如圖所示,下列相關敘述,哪些正確?
(A)含有羥基及烯烃
(B)可使紅棕色的溴水褪色
(C)可形成分子間氫鍵,易溶於水
(D)可與斐林試劑作用會產生紅色沉澱
(E)可與 \( K_2Cr_2O_7 \) 的硫酸溶液反應生成酮類化合物
114分科化學考科-14
[題組:第14-15題]某生在恆溫下進行 \( Na_2S_2O_3 \) 水溶液的分解反應速率實驗,反應式如下所示:
\[S_2O_3^{2-}+2H^+\rightarrow SO_2+S+H_2O\]
其實驗步驟如下:
(1) 在一個維形瓶中置入 50 mL 的 0.20 M \( Na_2S_2O_3 \) 溶液
(2) 在瓶子底部下方放置一張畫有黑色「X」標誌的白紙
(3) 將 10 mL 的 0.10 M HCl 溶液加入上述維形瓶中,並立刻按下秒錶且以玻棒攪拌
(4) 由維形瓶開口向下觀察,當無法看見白紙上「X」標誌時,停止計時並記錄時間 (t)
(5) 改變步驟(1)的 \( Na_2S_2O_3 \) 溶液體積,並另加入適量蒸餾水。再重複上述步驟進行實驗,結果如表所示。
| Na₂S₂O₃溶液體積(mL) | 蒸餾水體積(mL) | 標誌消失時間t(秒) | 1/t數值(1/秒) |
|---|---|---|---|
| 50.0 | 0 | 33.8 | 0.0296 |
| 30.0 | 20.0 | 49.2 | 0.0203 |
| 10.0 | 40.0 | 150 | 0.0067 |
14. 關於反應式的反應與實驗設計,下列敘述哪些正確?
(A)H⁺是催化劑
(B)是一個氧化還原反應
(C)三個實驗中,加入H⁺的濃度與體積為一定值
(D)可以用Na2S2O3 濃度對t 作圖,得知其為線性關係
(E)若使用20.0 mL Na2S2O3 溶液再進行一次實驗,需使用30.0 mL 蒸餾水
114分科化學考科-15
[題組:第14-15題]某生在恆溫下進行 \( Na_2S_2O_3 \) 水溶液的分解反應速率實驗,反應式如下所示:
\[S_2O_3^{2-}+2H^+\rightarrow SO_2+S+H_2O\]
… (實驗步驟與數據表同14題) …
15. 關於實驗結果與推論,下列敘述哪些正確?
(A) 此反應對S2O3²⁻而言為一級反應
(B) 看不清「X」標誌時,代表產生了0.5 mmol 的硫
(C) 看不清「X」標誌是由於產生的二氧化硫氣泡干擾
(D) 若將HCl 溶液濃度改為0.15 M 時,不會改變標誌消失的時間(t)
(E) 若固定反應總體積,並增加Na2S2O3溶液體積與減少蒸餾水體積,則標誌消失時間(t)將變小
114分科化學考科-16
[題組:第16-17題]甲烷(CH₄)是天然氣的主要成分,燃燒時可以產生1200-1800 K的高溫。右圖是CH₄與O₂的混合氣體燃燒時產生的火焰示意圖,其中Z軸標示了火焰的高度位置。以X=0、Z=0為起始點,完全燃燒時的火焰最高點為Z=1.0(cm),火焰高度按比例的相對值為Z=0.2、0.4……等,如圖所示。
科學家透過儀器分析,分別得到在X=0、Z=0至1.0位置的化學成分莫耳分率,結果如下圖所示。圖中O₂的莫耳分率數值範圍為0.72-0.92,而其他氣體的比例較少,莫耳分率數值範圍在0.0-0.20之間。
穩定的火焰中,下圖表示甲烷燃燒過程中的各氣體莫耳分率變化,可以呈現其燃燒的結果。
16. 關於此混合氣體燃燒實驗,下列敘述哪些正確?
(A)燃燒前混合氣體中CH₄與O₂的莫耳數比大於0.2
(B)燃燒前混合氣體中有H₂O及CO₂雜質
(C)燃燒過程共消耗掉約0.15莫耳的O₂
(D)完全燃燒後CH₄轉變生成CO₂與H₂O
(E)完全燃燒後產生之H₂O重量約為CO₂重量之2倍
114分科化學考科-17
[題組:第16-17題]… (題組敘述同16題) …
17. 下列敘述,哪些符合題目圖的觀測結果?
(A)H₂O的生成,在Z=0.1cm時的速率最快
(B)在Z=0.1cm時,每生成1.0莫耳H₂O伴隨0.5莫耳CO₂的生成
(C)在Z=0.2cm時,CH₄生成CO的速率比CO轉變為CO₂的速率快
(D)在Z=0.2cm時,CH₄生成CO的速率比生成H₂O的速率快
(E)在Z>0.3cm時,主要反應為CO的燃燒
114分科化學考科-18
18. 酵素可以催化反應,其第一步是和反應物產生作用,並結合形成複合體。附圖結構中甲代表反應物,乙代表某酵素中和甲結合部位的示意圖,丙是兩者結合後的複合體。若催化反應是甲的水解反應,下列敘述哪些正確?
(A)甲含有5對未鍵結電子對
(B)乙是由胺基酸結合而成
(C)丙中的分子間作用力包含氫鍵
(D)醋酸是反應產物之一
(E)反應後乙將脫去一分子水
114分科化學考科-19
19. 附圖為由硼砂(Na₂B₄O₇·10H₂O)製備硼元素(熔點:2076℃)的方法:
下列關於附圖的敘述,哪些正確?
(A)步驟①的產物B(OH)₃,亦可寫成H₃BO₃,此為鹼性物質,溶於水時會產生OH⁻
(B)步驟②的反應式為:\[2 B(OH)₃ \rightarrow B₂O₃ + 3 H₂O\]
(C)步驟③的反應式為:\[B₂O₃ + 3 Mg \rightarrow 2 B + 3 MgO\]
(D)步驟④不屬於氧化還原反應
(E)步驟⑤較易得到高純度的硼,是因為在高溫下進行,產物中只有硼是固體
114分科化學考科-20
[題組:第20-21題]某生量測三個鹼土族金屬的氫氧化合物之溶解度,方法如下:
(1) 取適量氫氧化合物置於錐形瓶中,加入蒸餾水後攪拌一天,然後靜置一天
(2) 由(1)的錐形瓶中取適當量的溶液,置於另一個錐形瓶中,以0.0020 M HCl的標準溶液滴定。實驗結果如表所示:
| 化合物 | 式量 | 取用體積(mL) | 標準酸滴定用量(mL) |
|---|---|---|---|
| Mg(OH)₂ | 58.3 | 50.0 | 8.12 |
| Ca(OH)₂ | 74.1 | 1.00 | 24.41 |
| Sr(OH)₂ | 121.6 | 0.500 | 34.87 |
20. 關於此實驗的步驟,下列敘述哪些正確?(多選)
(A)步驟(1)應將瓶口用軟木塞蓋緊
(B)步驟(1)靜置的目的是讓懸浮的固體顆粒沉積
(C)此實驗操作溶液溫度需要記錄
(D)步驟(2)應使用適當大小的量筒,取用準確體積的溶液
(E)步驟(2)若改用0.020 M HCl的標準溶液滴定,則可得到更精確的數據