111分科化學
111分科化學考科-22
[題組:第20-22題]
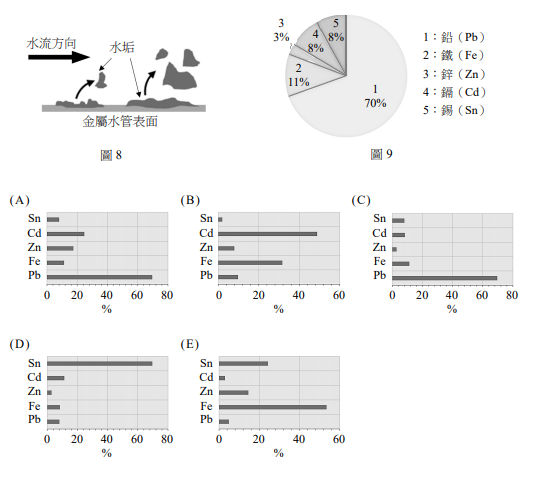
22 已知水垢中含有氫氧磷酸鉛(\( \text{Pb}_5(\text{PO}_4)_3\text{OH}) \) 。式(1)為氫氧磷酸鉛在水中的溶解平衡,若在水中添加含磷酸鹽的金屬腐蝕抑制劑後,是否能降低水中鉛濃度?並說明之。(2分)
\[ 5 \, \text{Pb}^{2+}(\text{aq}) + 3 \, \text{PO}_4^{3-}(\text{aq}) + \text{OH}^{-}(\text{aq}) \rightleftharpoons \text{Pb}_5(\text{PO}_4)_3\text{OH(s)} \quad \text{式(1)} \]
111分科化學考科-23
[題組:第23-24題]
具有相同透壓的溶液稱為等張溶液,細胞必須處於等張的環境才能存活,細胞若處於透壓比細胞內大的高張溶液,則細胞會因為液體流出細胞外造成萎縮而凋亡,高鹽分與糖分的酸變食品即是利用此一現象來進行食物保存。相反地,若細胞處於透壓低於細胞內的低張溶液中,則可能會因液體流入細胞內使細胞膨脹甚至破裂。回答下列問題:
23 已知有一單細胞細菌在27℃時,可存活於體積莫耳濃度0.25 M的等張硝酸銨溶液中。假設硝酸銨於水中完全解離,則此細菌細胞內的滲透壓為多少atm?(2分)
111分科化學考科-24
[題組:第23-24題]
24 某生製備了一重量百分率濃度1.8%且密度為1.0 g/mL的100克葡萄糖(莫耳質量為180 g/mol)水溶液,若在27℃下將上述單細胞細菌置於此溶液中,則此細菌細胞變化如何?(需算出溶液濃度)(2分)
111分科化學考科-25
[題組:第25-27題]
現代的社會強調「資源可持續回復」循環再生」的循環經濟。鉛蓄電池因使用量非常龐大,環保署公告2020年回收的廢鉛蓄電池總處理量高達6萬多公噸,而廢鉛蓄電池中主要含金屬鉛(Pb)、氧化鉛(PbO)、二氧化鉛(PbO₂)、硫酸鉛(PbSO₄)。某研究團隊設計以下流程,可從廢鉛蓄電池中提煉高純度的PbO。
I. 將含有廢鉛蓄電池的廢料、濃度2.0 M的H₂SO₄、0.1 M的FeSO₄(在溶液中解離成Fe²⁺和SO₄²⁻)溶液的混合物在65℃進行反應,所產生的PbSO₄可以式(2)表示:
\[ Pb(s) + PbO₂(s) + 2H₂SO₄(aq) \rightarrow 2PbSO₄(s) + 2H₂O(l) \]
II. 將實驗I的PbSO₄粗產物溶於10% NaOH溶液,加熱,並趁熱過濾;待濾液冷卻至室溫後,過濾並收集含PbO的粗產物。
III. 將實驗II的PbO粗產物置於35% NaOH溶液中,在110℃下攪拌至完全溶解後趁熱過濾,靜置濾液使其冷卻至室溫,可得高純度的黃色物質即為PbO。
25 實驗 III 使用何種純化技術提煉 PbO?(2分)
111分科化學考科-26
[題組:第25-27題]
該研究團隊為探究 \( \text{Fe}^{2+} \) 在實驗 I 中扮演的角色,利用鐵離子會與 SCN^- 產生錯合物的特性,又進行以下兩個實驗:
IV. 65°C時,於 2.0 M 的 H₂SO₄ 與 0.1 M 的 FeSO₄ 的水溶液中加入適量 KSCN 水溶液後,溶液幾乎無色;但是若加入少量 PbO₂ 後,溶液呈紅色,並有白色 PbSO₄ 固體產生。
V. 取出實驗 IV 的紅色溶液置於另一試管;在 65°C時,加入鉛粉,溶液又變成幾乎無色,且有白色 PbSO₄ 固體產生。
26 寫出實驗 IV 中,溶液呈紅色的原因為何?(2分)
111分科化學考科-27
[題組:第25-27題]
27 分別寫出實驗 IV 與 V 中生成 PbSO₄ 的淨離子平衡反應式。(4分)
111分科化學考科-28
[題組:第28-30題]
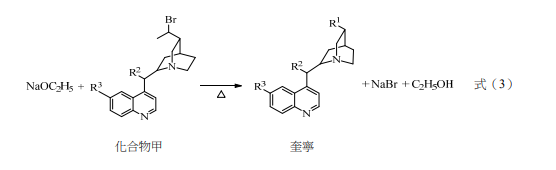
人類很早就已經知道奎寧樹皮的萃取物可治療瘧疾,其作用的主要成分是奎寧,別名金雞納霜或金雞納鹼,分子式為 C₂₀H₂₄N₂O₂,可用於治療與預防瘧疾及治療焦蟲症的藥物。奎寧化學結構如下圖所示,其中 \( R^1 \)、\( R^2 \)、\( R^3 \) 的結構並未標示出,但小雅由文獻中得知 \( R^1 \)、\( R^2 \)、\( R^3 \) 的結構共計含有 3 個 C、7 個 H 與 2 個 O,並可由以下實驗鑑定 \( R^1 \)、\( R^2 \)、\( R^3 \) 所含的官能基。
(一)奎寧可由化合物甲與乙醇鈉 (NaOC₂H₅) 加熱而得,如式(3)所示。
(二)若將適當氧化劑與奎寧作用,可產生酮官能基的產物,分子式為 C₂₀H₂₂N₂O₂。
(三)若將奎寧加入氯化鐵溶液,此溶液未變為紫色。
28 畫出取代基 \( R^1 \) 的結構。(2 分)