[題組:第1題]
已知氣氣與氯化氫反應後,可生成固體的產物,其反應式如下:
\[ \text{NH}_3 (\text{g}) + \text{HCl} (\text{g}) \rightarrow \text{NH}_4 \text{Cl} (\text{s}) \]
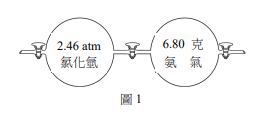
假設有一裝置容器,左、右各是2.00升的球體,中間有一個氣體閥門(如圖1)。在27℃,先將中間的氣體閥門關起來,左右邊球體內裝入6.80克的氣氣,在左邊球體裝入2.46 atm的氯化氫氣體。置入氣體後,將左、右氣體閥門關閉,再將中間氣體閥門打開,使左、右氣體完全混合且反應完全。假設氣氣和氯化氫氣體皆為理想氣體,且反應前後溫度不變,生成的固體體積可忽略。上述實驗後,容器內所剩的氣體與其壓力為何?
 (A) 1.23 atm的氣氣
(A) 1.23 atm的氣氣
(B) 2.46 atm的氣氣
(C) 3.69 atm的氣氣
(D) 1.23 atm的氯化氫
(E) 2.46 atm的氯化氫
理想氣體方程式
答案
111分科化學考科-09
112分科化學考科-10
25℃、1.0 大氣壓的某種混合氣體,其成分含有甲烷8.0 莫耳、乙烷1.0 莫耳及丙烷1.0莫耳。試問下列有關此混合氣體的敘述,哪些正確?(假設甲烷、乙烷、丙烷皆為理想氣體)
(A)甲烷的莫耳分率為0.80
(B)乙烷的分壓為1.0 atm
(C)丙烷的分壓為0.10 atm
(D)平均莫耳質量約為30 g/mol
(E)混合氣體的體積為24.5 L
答案
113分科化學考科-13
若將 \( N_2 \)、\( F_2 \) 及 \( NF_3 \) 接入一0.656升的密閉容器中,再藉由加熱使其進行下列反應:
\[N_2(g) + F_2(g) \rightleftharpoons NF_3(g) \quad (\text{反應式未平衡})\]
已知在527℃反應達平衡時,容器內各氣體的分壓分別為
\[P_{N_2} = 0.040 \, \text{atm} \quad P_{F_2} = 0.060 \, \text{atm} \quad P_{NF_3} = 0.700 \, \text{atm}\]
若三者皆符合理想氣體性質,則下列相關敘述,哪些正確?
(A)平衡反應式之最簡整係數總和為6
(B)密閉容器內的氣體總壓力為0.80 atm
(C)密閉容器內 \( N_2 \) 的莫耳數為 \( 6.1 \times 10^{-4} \) 莫耳
(D)此反應 \( K_p \) 的數值為 \( 5.67 \times 10^2 \)
(E)此反應 \( K_c \) 的數值大於 \( K_p \)
答案