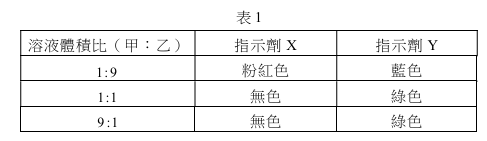
張同學以0.100M的NaOH水溶液滴定未知濃度的50.0 mL鹽酸溶液甲,當滴入48.0 mL的NaOH溶液時,發覺忘了加入酚酞指示劑。待加入指示劑後,發現溶液已呈現桃紅色。於是進行反滴定,先加入1.80 mL的0.100 M鹽酸溶液後,再滴入0.20 mL的NaOH溶液,即達到滴定終點,則此鹽酸溶液甲的濃度(M)為何?
(A) 0.093
(B) 0.103
(C) 0.156
(D) 0.186
(E) 0.206
中和反應的熱效應
答案
114學測自然考科31
乙酸和乙醇在硫酸催化下,可進行酯化反應如式1,假設乙酸與乙醇皆反應完全無殘留,蒸餾後可製得乙酸乙酯。氯化氫和氯氧化鈉的水溶液可進行反應如式2,與酯化反應類似,可產生1分子的水。
CH\(_3\)COOH(aq) + C\(_2\)H\(_5\)OH(l) \(\xrightarrow{\text{硫酸}}\) CH\(_3\)COOC\(_2\)H\(_5\)(l) + H\(_2\)O(l) 式1
HCl(aq) + NaOH(aq) \(\xrightarrow{\text{室溫}}\) NaCl(aq) + H\(_2\)O(l) 式2
比較這兩類反應,試問下列敘述,哪些正確?(應選3項)
(A)式1與式2的反應皆可寫成淨離子反應式:H\(^+\)(aq) + OH\(^-\)(aq) → H\(_2\)O(l)
(B)乙酸與氯化氫溶於水,可解離出H\(^+\),兩者皆為電解質
(C)乙酸與氯化氫溶於水,可解離出H\(^+\),兩者皆為離子化合物
(D)利用蒸餾法可取得乙酸乙酯,是利用產物間沸點不同的性質做分離
(E)式2為放熱反應
答案