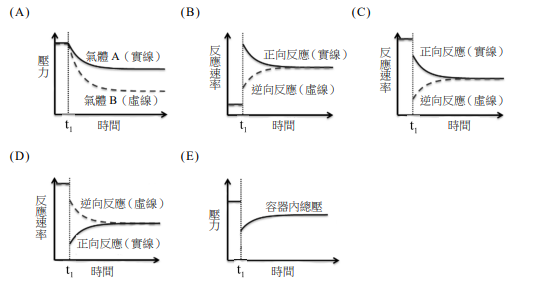
有一容器裝有\( X_2 \)、\( Y_2 \)兩種雙原子的氣體分子,其真實比為1:2,在定溫定壓下反應,反應完成後體積變為原來的1/2,若該反應只有一種產物,並且為氣體,則該氣體產物的分子式可能為何?
(A) \( X_2Y \)
(B) \( XY \)
(C) \( XY_2 \)
(D) \( X_3Y_2 \)
(E) \( X_2Y_3 \)
化學反應式配平
111分科化學考科-10
111分科化學考科-13
「大象牙膏」是一有趣的化學實驗:將濃度為30~35%的雙氧水與清潔劑混合,雙氧水分解產生的氧氣被清潔劑水溶液包裹住產生氣泡,此泡沫狀物質會像噴泉一樣噴湧而出。已知其化學反應式為:
\[ 2H_2O_2(l) \rightarrow 2H_2O(l) + O_2(g) \quad \Delta H^1 = -196 \, \text{kJ/mol} \]
活化能 \( E_a^1 = 76 \, \text{kJ/mol} \)。
若在此溶液中加入少量碘化鉀溶液,則泡沫噴湧的效果會更明顯。小安量測加入碘化鉀溶液後的反應活化能 \( E_a^2 = 57 \, \text{kJ/mol} \) 與反應熱 \(\Delta H^2 = -Q \, \text{kJ/mol} \)。此外,小安發現加入碘化鉀溶液後,碘離子會參與反應,而且有甲、乙兩反應發生。
甲:\( H_2O_2(l) + I^- (aq) \rightarrow Y(aq) + H_2O(l) \)
乙:\( H_2O_2(l) + Y(aq) \rightarrow Z(aq) + H_2O(l) + O_2(g) \)
已知甲、乙兩個反應的反應係數皆已平衡,且甲反應的反應速率小於乙反應的反應速率,小安分析反應後碘離子的量沒有減少。根據以上實驗觀察及結論,下列敘述哪些正確?
(A) \( Q > 196 \)
(B) \( Y \) 是 \( IO_3^- \)
(C) \( Z \) 是 \( I^- \)
(D) 甲反應活化能小於乙反應活化能
(E) 雙氧水在此實驗中既是氧化劑,也是還原劑
112分科化學考科-12
鉀與氯氣反應形成氯化鉀,其他學反應式和反應熱如式 2 所示:
\[ K(s) + \frac{1}{2} Cl_2(g) \rightarrow KCl(s) \quad \Delta H^0 = -437 \, kJ/mol \quad (\text{式 2}) \]
表 1 是相關過程的能量變化(\(\Delta H^0\)):
| 過程 | \(\Delta H^0\) (kJ/mol) |
|---|---|
| K(s) → K(g) | 甲 |
| K(g) → K⁺(g) + e⁻ | 乙 |
| Cl₂(g) → 2 Cl(g) | 丙 |
| Cl(g) + e⁻ → Cl⁻(g) | 丁 |
| K⁺(g) + Cl⁻(g) → KCl(s) | 戊 |
根據以上資料,試問下列敘述,哪些正確?
(A) 甲 + 乙 + 丙 + 丁 + 戊 = -437 kJ/mol
(B) 甲 > 0
(C) 乙 > 0
(D) 丙 > 0
(E) 以相同質量的鉀與氯氣完全反應產生氯化鉀,則氯為限量試劑
112分科化學考科-27
112分科化學考科-28
113分科化學考科-04
[題組:第4題至第5題]
陳同學依據下述三步驟,對某湖水樣進行溶氧量分析:
I. 量取97.0 mL 水樣,置於一100 mL 容量瓶中,加入1.0 mL 硫酸亞鈺(MnSO₄·2H₂O)以及1.0 mL 鹼性碘化鉀後,激烈搖晃,使瓶內溶液混合均勻,此時溶液中產生MnO₂沉澱。
II. 待沉澱不再增加後,隨即加入1.0 mL 濃硫酸,並以蒸餾水稀釋至刻度。
III. 從容量瓶中取出10.0 mL 溶液,隨即以0.015 M 硫代硫酸鉀溶液(Na₂S₂O₃)滴定。當滴定到達終點時,共耗去0.52 mL 硫代硫酸鉀溶液。
根據下列反應,一莫耳的氧氣可消耗多少莫耳硫代硫酸鉀?
\[ \text{Mn}^{2+} + 2\text{OH}^- \rightarrow \text{Mn(OH)}_2 \]
\[ 2\text{Mn(OH)}_2 + \text{O}_2 \rightarrow 2\text{MnO}_2 + 2\text{H}_2\text{O} \]
\[ \text{MnO}_2 + 2\text{I}^- + 4\text{H}^+ \rightarrow \text{Mn}^{2+} + \text{I}_2 + 2\text{H}_2\text{O} \]
\[ \text{I}_2 + 2\text{S}_2\text{O}_3^{2-} \rightarrow 2\text{I}^- + \text{S}_4\text{O}_6^{2-} \]
(A) 6
(B) 5
(C) 4
(D) 3
(E) 2
113分科化學考科-17
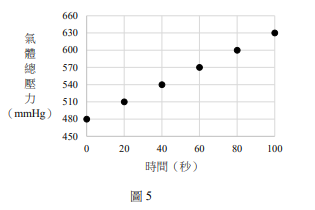
乙醇在高溫(>500 K)下,於氧化鋁的表面上會進行以下的反應:
\[ C_2H_5OH(g) \rightarrow C_2H_4(g) + H_2O(g) \]
若於一密閉容器中進行此反應,在不同的時間所量得容器內的氣體總壓力如圖5所示。
下列哪些敘述正確?
(A)此為一級反應
(B)乙醇的量減少至原來的一半時,需時160秒
(C)此反應的速率常數為15 mm Hg/秒
(D)第40秒時,\( C_2H_4 \) 的生成速率為1.5 mm Hg/秒
(E)反應時間為50秒時,乙醇的分壓為405 mmHg
113分科化學考科-20
[題組:第20題至第21題]
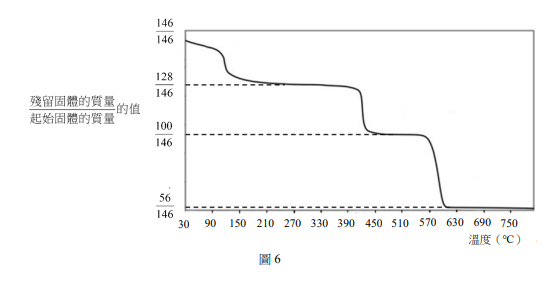
「鈣迴路」捕獲二氧化碳(CO\(_2\))是一種燃燒後處理技術。其原理是利用石灰(CaO)在高溫(>600℃)下吸收二氧化碳並形成灰石(CaCO\(_3\)),灰石在高溫煅燒中可再生成石灰及高純度的二氧化碳。捕獲二氧化碳的石灰常經由煅燒灰石製備,石灰也可經由煅燒草酸鈣石(CaC\(_2\)O\(_4\)·H\(_2\)O)而得;經由後者方法製備而得的石灰更加疏鬆多孔,表面積大,捕獲二氧化碳效率更高。某生以熱重量分析儀研究3.65毫克草酸鈣石受熱過程中固體質量隨溫度變化的情況,如圖6所示。橫坐標為溫度變化,其縱座標為殘留固體在當時溫度下的質量與起始固體質量的比值。
在360−480℃範圍內進行的化學反應為何?以最簡整係數的反應式表示。(2 分)
[題組題]113分科化學考科-21
[題組:第20題至第21題]
「鈣迴路」捕獲二氧化碳(CO\(_2\))是一種燃燒後處理技術。其原理是利用石灰(CaO)在高溫(>600℃)下吸收二氧化碳並形成灰石(CaCO\(_3\)),灰石在高溫煅燒中可再生成石灰及高純度的二氧化碳。捕獲二氧化碳的石灰常經由煅燒灰石製備,石灰也可經由煅燒草酸鈣石(CaC\(_2\)O\(_4\)·H\(_2\)O)而得;經由後者方法製備而得的石灰更加疏鬆多孔,表面積大,捕獲二氧化碳效率更高。某生以熱重量分析儀研究3.65毫克草酸鈣石受熱過程中固體質量隨溫度變化的情況,如圖6所示。橫坐標為溫度變化,其縱座標為殘留固體在當時溫度下的質量與起始固體質量的比值。
煅燒草酸鈣石產生的石灰較煅燒灰石產生的石灰疏鬆多孔,李同學推論其原因為:煅燒等莫耳數的草酸鈣石與灰石,草酸鈣石所產生較多氣體所致,以相關化學反應式說明李同學的推論。(2 分)