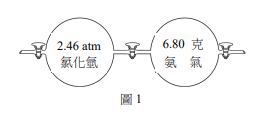
有一化學反應式:a甲(aq)+b乙(aq)→c丙(s)+d丁(aq),其中甲、乙、丙、丁為四種化合物代號,a、b、c、d為平衡係數。若以2M甲溶液,分別和1M乙溶液進行多次反應,得到表2的數據。
| 次別 | 2M甲溶液用量(mL) | 1M乙溶液用量(mL) | 丙沉澱量(g) |
| 實驗一 | 20 | 4 | 0.30 |
| 實驗二 | 20 | 8 | 0.60 |
| 實驗三 | 20 | 12 | 0.90 |
| 實驗四 | 20 | 16 | 1.00 |
| 實驗五 | 20 | 20 | 1.00 |
根據表2中的數據,試問下列敘述,哪些正確?
(A)實驗一至三的3個實驗中,甲溶液為過量
(B)實驗三至五中,實驗四中的乙溶液尚未過量
(C)由實驗三至四可知,只要(40/3)mL的乙溶液,即可恰好與20 mL甲溶液完全反應
(D)若改用0.3 M甲溶液50 mL,則需0.25 M乙溶液30 mL,才能恰好完全反應
(E)若取足夠的0.25 M乙溶液與50 mL的0.3 M甲溶液完全反應,則可得0.375 g的丙沉澱