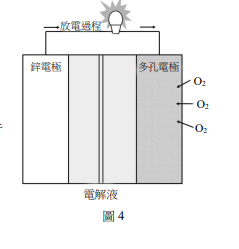
[題組:第14-15題]某生在恆溫下進行 \( Na_2S_2O_3 \) 水溶液的分解反應速率實驗,反應式如下所示:
\[S_2O_3^{2-}+2H^+\rightarrow SO_2+S+H_2O\]
其實驗步驟如下:
(1) 在一個維形瓶中置入 50 mL 的 0.20 M \( Na_2S_2O_3 \) 溶液
(2) 在瓶子底部下方放置一張畫有黑色「X」標誌的白紙
(3) 將 10 mL 的 0.10 M HCl 溶液加入上述維形瓶中,並立刻按下秒錶且以玻棒攪拌
(4) 由維形瓶開口向下觀察,當無法看見白紙上「X」標誌時,停止計時並記錄時間 (t)
(5) 改變步驟(1)的 \( Na_2S_2O_3 \) 溶液體積,並另加入適量蒸餾水。再重複上述步驟進行實驗,結果如表所示。
| Na₂S₂O₃溶液體積(mL) |
蒸餾水體積(mL) |
標誌消失時間t(秒) |
1/t數值(1/秒) |
| 50.0 |
0 |
33.8 |
0.0296 |
| 30.0 |
20.0 |
49.2 |
0.0203 |
| 10.0 |
40.0 |
150 |
0.0067 |
14. 關於反應式的反應與實驗設計,下列敘述哪些正確?
(A)H⁺是催化劑
(B)是一個氧化還原反應
(C)三個實驗中,加入H⁺的濃度與體積為一定值
(D)可以用Na2S2O3 濃度對t 作圖,得知其為線性關係
(E)若使用20.0 mL Na2S2O3 溶液再進行一次實驗,需使用30.0 mL 蒸餾水
[題組題]
答案
(A)錯誤,H⁺是反應物,非催化劑。
(B)正確,S₂O₃²⁻中S平均氧化數為+2,產物S為0,SO₂中S為+4,有氧化數變化。
(C)正確,每次實驗加入的HCl體積與濃度固定。
(D)錯誤,[Na₂S₂O₃]對t作圖非線性;對1/t作圖接近線性,表示反應速率與[Na₂S₂O₃]成正比。
(E)正確,總體積固定為60 mL,故20 mL Na₂S₂O₃需加40 mL水?(原表總體積為60 mL? 50+10=60, 30+20+10=60, 10+40+10=60,若用20 mL Na₂S₂O₃,則需加蒸餾水60-20-10=30 mL)。答案:BCE