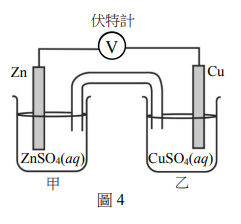
氯氣與氧氣反應,可生成一氧化氮,其反應式如下:
\[NH_3 + O_2 \rightarrow NO + H_2O \quad (\text{未平衡})\]
一氧化氮與氧氣反應生成二氧化碳,其反應式如下:
\[NO + O_2 \rightarrow NO_2 \quad (\text{未平衡})\]
若分別將此二化學反應式平衡,並取最小整數,試問下列哪一數字不會是兩個平衡反應式中的係數?
(A) 1 (B) 2 (C) 3 (D) 4 (E) 5
氧化還原
109學測自然試題-60
西元2019年,諾貝爾化學獎頒給對鋰離子電池研究有重大貢獻的學者,鋰離子電池作用原理是利用鋰離子在兩電極之間的移動來充放電能。常見的鋰離子電池使用鋰離子嵌入石墨當作陽極,石墨的二維多層結構有助於與鋰離子結合以及移動,因此可作為電池之陽極材料,在放置時其他學反應如下(\( C_6 \)表示每六個碳原子可以嵌入一個鋰離子):
\[LiC_6 \rightleftharpoons C_6 + Li^+ + e^- \quad (\text{式1})\]
常用的陰極材料為氧化鈉等能與鋰離子結合的氧化物,在放置時其他學反應為:
\[CoO_2 + Li^+ + e^- \rightleftharpoons LiCoO_2 \quad (\text{式2})\]
結合式1與式2,放置時電池總反應為:
\[CoO_2 + LiC_6 \rightleftharpoons LiCoO_2 + C_6 \quad (\text{式3})\]
此反應在正常操作下為可逆反應,因此鋰離子電池可以反覆充放電。下列敘述哪些正確?(應選2項)
(A)在放置反應中(式3),石墨作為氧化劑
(B)將石墨換成鐵石材料的三維結構,應可儲存更多鋰離子,讓電池更有效率
(C)式3的反應由左到右為放熱反應
(D)放置時,鋰離子與電子由石墨層中釋放出來
(E)鋰離子電池破裂後有起火爆炸的危險,因為鋰離子活性很高,遇水會燃燒
109學測自然試題-61
某一金屬離子溶液,其實驗結果如下:
(1)加入碘離子或氯離子於溶液中,皆會形成沉澱
(2)將鎳金屬片放入此金屬離子溶液中,發現溶液由無色轉變為綠色
(3)將銅片放入此金屬離子溶液中,會發生氧化還原反應
下列何者為此金屬離子?
(A)鐵(Ⅲ)離子 (B)銀離子 (C)銅離子
(D)鉛離子 (E)汞離子
(1)加I⁻或Cl⁻皆沉澱,表示該離子與I⁻、Cl⁻形成難溶鹽。Ag⁺與Cl⁻、I⁻皆沉澱(B可能)。Pb²⁺與I⁻沉澱(PbI₂),與Cl⁻在冷水中沉澱(PbCl₂)(D可能)。Hg₂²⁺與I⁻、Cl⁻沉澱?Hg²⁺與I⁻沉澱(HgI₂),與Cl⁻? HgCl₂可溶(E排除)。Fe³⁺與I⁻發生氧化還原,不形成FeI₃沉澱(A排除)。Cu²⁺與I⁻發生氧化還原生成CuI沉澱和I₂,與Cl⁻不沉澱(C排除)。(2)Ni片放入,溶液變綠色。Ni可還原某些金屬離子,若還原Ag⁺則生成Ni²⁺(綠色)?Ni²⁺水合離子為綠色。但Ag⁺被還原為Ag(s),溶液應無色,不會變綠(B排除)。Pb²⁺被Ni還原為Pb(s),溶液無色?Ni²⁺綠色,若反應發生,生成Ni²⁺則溶液變綠,符合(2)。(3)Cu片放入發生氧化還原。Cu可還原Pb²⁺嗎?標準還原電位E°(Pb²⁺/Pb) = -0.13 V,E°(Cu²⁺/Cu)=+0.34 V,E°(Ni²⁺/Ni)=-0.25 V。Cu不能還原Pb²⁺(E°(Pb²⁺/Pb) > E°(Ni²⁺/Ni),但E°(Pb²⁺/Pb) < E°(Cu²⁺/Cu),故Cu不能自發還原Pb²⁺(D排除)。重新考慮(3) Cu片發生反應,表示該金屬離子氧化性比Cu²⁺強,可氧化Cu。Ag⁺可氧化Cu:2Ag⁺ + Cu → 2Ag + Cu²⁺,但(2)中Ni還原Ag⁺生成Ni²⁺(綠色)符合。且(1)Ag⁺與Cl⁻、I⁻皆沉澱。故答案(B)銀離子。
108學測自然試題-31
鉛蓄電池(又稱鉛酸電池)是汽機車主要的電源,是以金屬鉛及二氧化碳作為電極,而以 30% 的硫酸作為電解液。已知鉛蓄電池放電時,其反應如下:
\[ \text{Pb(s)} + \text{PbO}_2(\text{s}) + 2\text{H}_2\text{SO}_4(\text{aq}) \rightarrow 2\text{PbSO}_4(\text{s}) + 2\text{H}_2\text{O(l)} \]
下列有關鉛蓄電池的敘述,哪些正確?(應選 3 項)
(A) 鉛蓄電池放電時,陽極之重量會減少
(B) 鉛蓄電池放電時,陰極之重量會增加
(C) 隨著鉛蓄電池放電,硫酸溶液的濃度會降低
(D) 鉛蓄電池充電時,氧化劑和還原劑是同一種物質
(E) 鉛蓄電池故障報廢時,應交由垃圾車送至掩埋場棄置
107學測自然試題-01
X、Y、Z 分別為週期表中,第二與三週期中的三種元素,其原子序之和為 25,在週期表的相對位置如表 1。由這三種元素,可組成許多化合物。
下列有關這三種元素以及其組成化合物的敘述,哪些正確?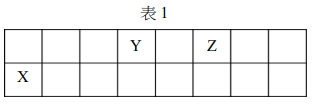
甲、這三種元素中,只有一種是非金屬元素。
乙、Z 容易失去兩個電子,形成 Z²⁺ 離子。
丙、由 Y 與 Z 可以組成氣體分子。
丁、X 的價電子數為 1。
(A) 甲乙 (B) 乙丙 (C) 丙丁 (D) 甲丙 (E) 乙丁
設 X、Y、Z 原子序分別為 a、b、c,且 Y 在 X 下方,Z 在 Y 右方。因第二週期有 8 元素,第三週期也有 8 元素,且 a+b+c=25,推得可能為 X=氧(8)、Y=硫(16)、Z=氯(17),但和為 41 不符;若 X=氮(7)、Y=磷(15)、Z=硫(16),和為 38 不符;若 X=碳(6)、Y=矽(14)、Z=磷(15),和為 35 不符;若 X=硼(5)、Y=鋁(13)、Z=矽(14),和為 32 不符;若 X=鈹(4)、Y=鎂(12)、Z=鋁(13),和為 29 不符;若 X=鋰(3)、Y=鈉(11)、Z=鎂(12),和為 26 不符;若 X=氦(2) 不可能,因第二週期。若 X 在第二週期,Y 在第三週期,Z 在第三週期 Y 右一格,設 X 原子序 p,Y=p+8,Z=p+9,則 p+(p+8)+(p+9)=25,3p+17=25,3p=8,p 非整數。若 Z 在 Y 下方則不合理。若 X、Y、Z 為連續三格:設 Y=p,X=p-1,Z=p+1,則 (p-1)+p+(p+1)=3p=25,p 非整數。若 X 在 Y 左上方,Z 在 Y 右方:設 X=p,Y=p+8,Z=p+9,得 3p+17=25,p=8/3 不行。若 X 在 Y 左方,Z 在 Y 下方:設 X=p,Y=p+1,Z=p+9,得 3p+10=25,p=5,則 X=硼(5),Y=碳(6),Z=矽(14),和為 25 合理。檢查:X=硼(5),價電子 3,丁錯。Y=碳(6),非金屬,Z=矽(14),類金屬。甲:三種元素中非金屬只有碳(1 種) → 對。乙:Z=矽,不易形成 Si²⁺ → 錯。丙:Y=碳,Z=矽,可形成 SiC 固體,不是氣體分子 → 錯。丁:X=硼,價電子數 3 → 錯。這樣甲對,乙丙丁錯,無此選項。重新考慮:若 X=氮(7),Y=矽(14),Z=磷(15) 不行,和 36。若 X=碳(6),Y=鋁(13),Z=矽(14) 和 33。若 X=硼(5),Y=鎂(12),Z=鋁(13) 和 30。若 X=鈹(4),Y=鈉(11),Z=鎂(12) 和 27。若 X=鋰(3),Y=氖(10) 不行,因 Y 在第三週期。若 X=氧(8),Y=硫(16),Z=氯(17) 和 41。若 X=氟(9),Y=氯(17),Z=氬(18) 和 44。若 X=氮(7),Y=磷(15),Z=硫(16) 和 38。若 X=碳(6),Y=矽(14),Z=磷(15) 和 35。若 X=硼(5),Y=鋁(13),Z=矽(14) 和 32。若 X=鈹(4),Y=鎂(12),Z=鋁(13) 和 29。若 X=鋰(3),Y=鈉(11),Z=鎂(12) 和 26。若 X=氦(2) 不行。若 X 在第二週期,Y 在第三週期且 Z 在 Y 右一格:設 X=p,Y=p+8,Z=p+9,得 3p+17=25,p=8/3 不行。若 Z 在 Y 下方:設 X=p,Y=p+8,Z=p+16,得 3p+24=25,p=1/3 不行。若 X 在 Y 左方,Z 在 Y 下方:設 X=p,Y=p+1,Z=p+9,得 3p+10=25,p=5,X=硼(5),Y=碳(6),Z=矽(14),和 25。檢查:甲:非金屬有 Y=碳,Z=矽是類金屬,X=硼是類金屬,所以非金屬只有碳(1 種) → 對。乙:Z=矽,不易失去 2 電子形成 Si²⁺ → 錯。丙:Y 與 Z 可形成 SiC(碳化矽)固體,不是氣體 → 錯。丁:X=硼,價電子數 3 → 錯。這樣只有甲對,無選項。若 X=碳(6),Y=氮(7),Z=磷(15) 不行,和 28。若 X=氮(7),Y=氧(8),Z=硫(16) 和 31。若 X=氧(8),Y=氟(9),Z=氯(17) 和 34。若 X=氟(9),Y=氖(10) 不行。若 X=鈹(4),Y=硼(5),Z=矽(14) 不行,因 Y 不在第三週期。若 X=鋰(3),Y=鈹(4),Z=鎂(12) 不行。若 X=碳(6),Y=鋁(13),Z=矽(14) 和 33。若 X=氮(7),Y=矽(14),Z=磷(15) 和 36。若 X=氧(8),Y=磷(15),Z=硫(16) 和 39。若 X=氟(9),Y=硫(16),Z=氯(17) 和 42。若 X=氖(10) 不行。若 X=硼(5),Y=碳(6),Z=鋁(13) 不行,因 Z 不在 Y 右或下。若 X=碳(6),Y=氮(7),Z=鋁(13) 不行。若 X=氮(7),Y=氧(8),Z=矽(14) 不行。若 X=氧(8),Y=氟(9),Z=磷(15) 不行。若 X=氟(9),Y=氖(10) 不行。若 X=鈹(4),Y=氮(7),Z=磷(15) 不行。若 X=鋰(3),Y=碳(6),Z=矽(14) 不行。若 X=氦(2),Y=鈹(4),Z=硼(5) 不行。若 X=硼(5),Y=氧(8),Z=硫(16) 不行。若 X=碳(6),Y=氟(9),Z=氯(17) 不行。若 X=氮(7),Y=氖(10) 不行。若 X=氧(8),Y=鈉(11),Z=鎂(12) 和 31。若 X=氟(9),Y=鎂(12),Z=鋁(13) 和 34。若 X=氖(10) 不行。若 X=鈉(11) 已在第三週期,不符合「第二與三週期」。所以唯一可能是 X=鎂(12),Y=鋁(13),Z=矽(14) 和 39 太大。若 X=鈹(4),Y=鈉(11),Z=鎂(12) 和 27。若 X=鋰(3),Y=鈉(11),Z=鋁(13) 和 27。若 X=氦(2),Y=鈉(11),Z=鎂(12) 和 25。此可行:X=氦(2) 在第二週期最右,Y=鈉(11) 在第三週期最左,Z=鎂(12) 在 Y 右一格。檢查:甲:非金屬有 X=氦(惰性氣體),Y=鈉(金屬),Z=鎂(金屬) → 非金屬只有 1 種 → 對。乙:Z=鎂,易失去 2 電子形成 Mg²⁺ → 對。丙:Y=鈉,Z=鎂,不會組成氣體分子 → 錯。丁:X=氦,價電子數 2(滿殼) → 錯。故甲乙對 → 選 (A)。
106學測自然試題-27
106學測自然試題-54
下列哪一種現象或作用,不涉及氧化還原反應?
(A)煉鐵時加入煤焦
(B)鉛粉與鹽酸作用
(C)蘋果切開後曝於空氣
(D)硝酸銀水溶液加入食鹽
(E)具金屬光澤的銅線在空氣中受熱
110學測自然試卷_05
自然界中,氧化還原反應扮演著重要的角色,下列有關碳循環的過程,何者沒有牽涉到氧化還原反應?
(A)細胞呼吸是利用葡萄糖反應產生二氧化碳,並釋出能量
(B)生物體內的碳水化合物逐漸在地層中沉積,最後轉變成煤
(C)煤和石油在空氣中燃燒產生二氧化碳
(D)二氧化碳溶於水,與鈣離子(Ca\(^{2+}\))結合,以碳酸鈣沉澱的方式積存於海底
(E)二氧化碳經由光合作用轉變為葡萄糖,並釋放出氧氣
110學測自然試卷_48
48. 乾電池的正極是碳棒(石墨棒),負極是外殼的金屬鋅,碳棒周圍是碳粉、NH\(_4\)Cl、ZnCl\(_2\)、MnO\(_2\)、澱粉及水等組成的糊狀填充物。乾電池兩極的半反應如下:
正極:\[ 2 \text{MnO}_2(s) + 2 \text{NH}_4\text{Cl}(aq) + Zn^{2+}(aq) + 2e^- \rightarrow \text{Mn}_2\text{O}_3(s) + \text{Zn(NH}_3)_2\text{Cl}_2(aq) + \text{H}_2\text{O(l)} \]
負極:\[ Zn(s) \rightarrow Zn^{2+}(aq) + 2e^- \]
已知MnO\(_2\)、碳粉及Mn\(_2\)O\(_3\)不溶於水,NH\(_4\)Cl與ZnCl\(_2\)可溶於水。
下列相關敘述,哪些正確?(應選3項)
(A)同一顆乾電池所含的NH\(_4\)Cl質量,新電池較廢電池為高
(B)同一顆乾電池所含的ZnCl\(_2\)質量,新電池較廢電池為低
(C)同一顆乾電池所含的MnO\(_2\)質量,新電池較廢電池為高
(D)放電過程中,糊狀物中的鋅離子莫耳數逐漸變少
(E)廢乾電池的糊狀填充物加水處理,過濾後的濾渣在空氣中加熱,其中碳粉會變成CO\(_2\)、Mn\(_2\)O\(_3\)會轉化成MnO\(_2\),藉此可回收廢電池中的MnO\(_2\)