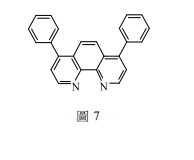
沉澱反應
111分科化學考科-03
[題組:第3-4題]
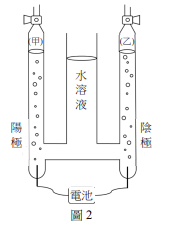
實驗課時進行電解濃食鹽水的實驗,實驗設計是以碳棒做為電極。大部分的學生實驗結果如圖 2 所示,陰極與陽極皆會產生氣體,且甲管與乙管的液面高度大致相同。
表1
| 半反應式 | E° (V) |
|---|---|
| \(\text{O}_2\text{(g)} + 4\text{H}^+ + 4\text{e}^- \rightarrow 2\text{H}_2\text{O}\) | 1.229 |
| \(\text{SO}_4^{2-} + \text{H}_2\text{O} + 2\text{e}^- \rightarrow \text{SO}_3^{2-} + 2\text{OH}^-\) | -0.936 |
| \(\text{NO}_3^-(\text{aq}) + 2\text{H}^+ + \text{e}^- \rightarrow \text{NO}_2\text{(g)} + \text{H}_2\text{O}\) | 0.80 |
| \(\text{Cl}_2\text{(g)} + 2\text{e}^- \rightarrow 2\text{Cl}^-\) | 1.36 |
| \(\text{Ag}^+(\text{aq}) + \text{e}^- \rightarrow \text{Ag(s)}\) | 0.80 |
但是,有五組的學生誤將其他鹽類當成食鹽配成水溶液進行電解實驗。誤拿的五種鹽類,事後發現應為亞硫酸鈉、硝酸銀、氯化鉀、硫酸鎂、硝酸銅。學生找資料查到可能相關的標準還原電位數據,如表 1 所示。根據以上結果,回答下列問題。
3 在大部分學生正確使用濃食鹽水的結果中,甲管的氣體應為下列何者?
(A)氫氣
(B)氧氣
(C)氮氣
(D)氯氣
(E)二氧化碳
111分科化學考科-04
111分科化學考科-12
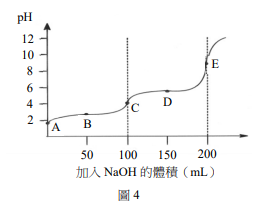
以0.10 M NaOH溶液滴定200 mL 0.050 M之某有機酸溶液,其滴定曲線如圖4所示。下列關於此有機酸的敘述,哪些正確?
(A) \( K_{a1} \) 大於 \( 10^{-4} \)
(B) 此有機酸為單質子酸
(C) 在pH5.5附近有很好的緩衝效果
(D) 當溶液的pH=10時,該有機酸呈帶+1價離子
(E) 於上述有機酸溶液中加入0.10 M NaOH溶液100 mL時,溶液的pH值接近7.0
111分科化學考科-26
[題組:第25-27題]
該研究團隊為探究 \( \text{Fe}^{2+} \) 在實驗 I 中扮演的角色,利用鐵離子會與 SCN^- 產生錯合物的特性,又進行以下兩個實驗:
IV. 65°C時,於 2.0 M 的 H₂SO₄ 與 0.1 M 的 FeSO₄ 的水溶液中加入適量 KSCN 水溶液後,溶液幾乎無色;但是若加入少量 PbO₂ 後,溶液呈紅色,並有白色 PbSO₄ 固體產生。
V. 取出實驗 IV 的紅色溶液置於另一試管;在 65°C時,加入鉛粉,溶液又變成幾乎無色,且有白色 PbSO₄ 固體產生。
26 寫出實驗 IV 中,溶液呈紅色的原因為何?(2分)
111分科化學考科-27
112分科化學考科-09
五種含硫的化合物,分別為:H2S、SO3、SF6、SF4 與SF2。試問下列有關這些化合物的敘述,哪些正確?
(A) H2S 可作為還原劑
(B) SO3 的水溶液為酸性
(C) SF6 的氣體密度比空氣小
(D) SF4 的路易斯結構符合八隅體
(E) SF2 的分子形狀與H2S 相似
112分科化學考科-11
112分科化學考科-22
113分科化學考科-04
[題組:第4題至第5題]
陳同學依據下述三步驟,對某湖水樣進行溶氧量分析:
I. 量取97.0 mL 水樣,置於一100 mL 容量瓶中,加入1.0 mL 硫酸亞鈺(MnSO₄·2H₂O)以及1.0 mL 鹼性碘化鉀後,激烈搖晃,使瓶內溶液混合均勻,此時溶液中產生MnO₂沉澱。
II. 待沉澱不再增加後,隨即加入1.0 mL 濃硫酸,並以蒸餾水稀釋至刻度。
III. 從容量瓶中取出10.0 mL 溶液,隨即以0.015 M 硫代硫酸鉀溶液(Na₂S₂O₃)滴定。當滴定到達終點時,共耗去0.52 mL 硫代硫酸鉀溶液。
根據下列反應,一莫耳的氧氣可消耗多少莫耳硫代硫酸鉀?
\[ \text{Mn}^{2+} + 2\text{OH}^- \rightarrow \text{Mn(OH)}_2 \]
\[ 2\text{Mn(OH)}_2 + \text{O}_2 \rightarrow 2\text{MnO}_2 + 2\text{H}_2\text{O} \]
\[ \text{MnO}_2 + 2\text{I}^- + 4\text{H}^+ \rightarrow \text{Mn}^{2+} + \text{I}_2 + 2\text{H}_2\text{O} \]
\[ \text{I}_2 + 2\text{S}_2\text{O}_3^{2-} \rightarrow 2\text{I}^- + \text{S}_4\text{O}_6^{2-} \]
(A) 6
(B) 5
(C) 4
(D) 3
(E) 2