[題組:第22題至第24題]
生質柴油是具有發展性可替代石油的永續能源之一,可直接或混合石化柴油作為燃料。生質柴油是脂肪酸單烷基酯,可利用廢食用油脂,經由酯交換反應得到,如式(1)所示。酯交換反應可經由鹼或酵素催化進行,其中鹼催化反應的反應速率快,且催化劑用量較少,成本低廉,常用於製備生質柴油。
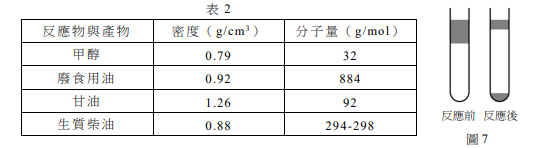
小華依據化學反應式(2),在實驗室中製備生質柴油;取0.12克氫氧化鉀溶於3毫升甲醇(約為0.074莫耳)後放入試管中,再加入12毫升的廢食用油(約為0.012莫耳),充分混合並加熱使反應完全。
小華發現上述反應前後的試管中有不互溶的液體(圖7),已知相關反應物與產物的密度與分子量列於表2。
下列敘述哪些正確?(多選)
(A)反應前上層為廢食用油
(B)反應前上層溶液可使紅色石蕊試紙變色
(C)反應後最下層溶液可使藍色石蕊試紙變色
(D)反應後無甲醇剩餘
(E)反應後產生的甘油約1.10克
[題組題]
答案
依密度:反應前上層為甲醇(0.79),下層為廢食用油(0.92);反應後上層為甲醇/生質柴油,中層為生質柴油(0.88),下層為甘油(1.26)。
(B) 上層含KOH,鹼性使紅色石蕊變藍。
(E) 甘油莫耳數=廢食用油莫耳數=0.012 mol,質量=0.012×92=1.104 g。
(A) 反應前上層為甲醇;
(C) 甘油中性,不使石蕊變色;
(D) 甲醇過量,有剩餘。答案:(B)(E)