[題組:第4題至第5題]
陳同學依據下述三步驟,對某湖水樣進行溶氧量分析:
I. 量取97.0 mL 水樣,置於一100 mL 容量瓶中,加入1.0 mL 硫酸亞鈺(MnSO₄·2H₂O)以及1.0 mL 鹼性碘化鉀後,激烈搖晃,使瓶內溶液混合均勻,此時溶液中產生MnO₂沉澱。
II. 待沉澱不再增加後,隨即加入1.0 mL 濃硫酸,並以蒸餾水稀釋至刻度。
III. 從容量瓶中取出10.0 mL 溶液,隨即以0.015 M 硫代硫酸鉀溶液(Na₂S₂O₃)滴定。當滴定到達終點時,共耗去0.52 mL 硫代硫酸鉀溶液。
根據下列反應,一莫耳的氧氣可消耗多少莫耳硫代硫酸鉀?
\[ \text{Mn}^{2+} + 2\text{OH}^- \rightarrow \text{Mn(OH)}_2 \]
\[ 2\text{Mn(OH)}_2 + \text{O}_2 \rightarrow 2\text{MnO}_2 + 2\text{H}_2\text{O} \]
\[ \text{MnO}_2 + 2\text{I}^- + 4\text{H}^+ \rightarrow \text{Mn}^{2+} + \text{I}_2 + 2\text{H}_2\text{O} \]
\[ \text{I}_2 + 2\text{S}_2\text{O}_3^{2-} \rightarrow 2\text{I}^- + \text{S}_4\text{O}_6^{2-} \]
(A) 6
(B) 5
(C) 4
(D) 3
(E) 2
化學計量
113分科化學考科-05
[題組:第4題至第5題]
陳同學依據下述三步驟,對某湖水樣進行溶氧量分析:
I. 量取97.0 mL 水樣,置於一100 mL 容量瓶中,加入1.0 mL 硫酸亞鈺(MnSO₄·2H₂O)以及1.0 mL 鹼性碘化鉀後,激烈搖晃,使瓶內溶液混合均勻,此時溶液中產生MnO₂沉澱。
II. 待沉澱不再增加後,隨即加入1.0 mL 濃硫酸,並以蒸餾水稀釋至刻度。
III. 從容量瓶中取出10.0 mL 溶液,隨即以0.015 M 硫代硫酸鉀溶液(Na₂S₂O₃)滴定。當滴定到達終點時,共耗去0.52 mL 硫代硫酸鉀溶液。
下列哪一數值最接近水樣中的溶氧量(單位:M)?(0.015 × 0.52 = 7.8 × 10⁻³)
(A) \(1.0 \times 10^{-4}\)
(B) \(2.0 \times 10^{-4}\)
(C) \(4.0 \times 10^{-4}\)
(D) \(6.0 \times 10^{-4}\)
(E) \(8.0 \times 10^{-4}\)
113分科化學考科-07
某蛋白質中鐵元素的重量百分比為0.33%,將此蛋白質0.20克溶於水中配成10.0毫升的溶液,此溶液在25℃下的滲透壓為5.5 torr。每莫耳的此蛋白質含有多少莫耳的鐵原子?
\[ \text{已知} \quad \text{1atm}=760 \, \text{torr} \quad , \quad 20 \times 82 \times 298 \times 760 = 6.75 \times 10^7 \, \text{Fe的原子量} = 56.0 \]
(A) 5
(B) 4
(C) 3
(D) 2
(E) 1
113分科化學考科-23
[題組:第22題至第24題]
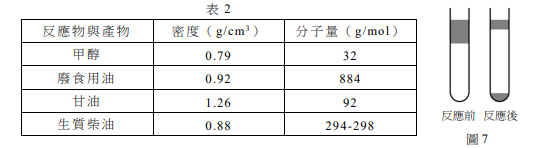
生質柴油是具有發展性可替代石油的永續能源之一,可直接或混合石化柴油作為燃料。生質柴油是脂肪酸單烷基酯,可利用廢食用油脂,經由酯交換反應得到,如式(1)所示。酯交換反應可經由鹼或酵素催化進行,其中鹼催化反應的反應速率快,且催化劑用量較少,成本低廉,常用於製備生質柴油。
小華依據化學反應式(2),在實驗室中製備生質柴油;取0.12克氫氧化鉀溶於3毫升甲醇(約為0.074莫耳)後放入試管中,再加入12毫升的廢食用油(約為0.012莫耳),充分混合並加熱使反應完全。
小華發現上述反應前後的試管中有不互溶的液體(圖7),已知相關反應物與產物的密度與分子量列於表2。
下列敘述哪些正確?(多選)
(A)反應前上層為廢食用油
(B)反應前上層溶液可使紅色石蕊試紙變色
(C)反應後最下層溶液可使藍色石蕊試紙變色
(D)反應後無甲醇剩餘
(E)反應後產生的甘油約1.10克
114分科化學考科-02
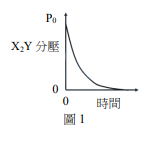
定溫定容下,某氣體(X2Y)可進行分解反應,其化學反應式:
\[X_2Y_{(g)} → X_2_{(g)}+Y_{(g)}\]
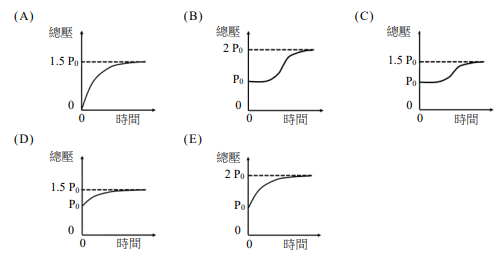
已知$X_2Y、X_2 及Y$ 彼此之間互不反應,且三者皆可視為理想氣體。若初始的容器內僅有$X_2Y$,其壓力為$P_0$;反應過程中,$X_2Y$分壓與時間的關係如圖所示,則容器內總壓隨時間的變化可能為何?
[單選題]114分科化學考科-03
114分科化學考科-04
將 pH = 2.0 的 HCl 水溶液 50 mL,與一未知濃度的 KOH 水溶液 50 mL 均勻混合後,若溫度沒有改變,體積為 100 mL,此溶液的 pH 值為 4.0。則原來 KOH 水溶液的濃度(M)為下列何者?
(A) 0.098
(B) 0.0098
(C) 0.0049
(D) 0.0018
(E) 0.00098
114分科化學考科-05
氣體A 與氣體B 反應生成氣體C。在定溫下,某固定體積的密閉容器中,A、B 與C 的起始濃度分別為1.000 M、1.500 M 與1.000 M;當反應達到平衡後,A 的濃度為0.921 M,B 的濃度為1.342 M,C 的濃度為1.158 M。試問此反應的化學反應式為何?
(A) A+B ⇌ 2C
(B) A+2B ⇌ 2C
(C) 2A+B ⇌ C
(D) A+3B ⇌ 2C
(E) 2A+3B ⇌ 3C
114分科化學考科-15
[題組:第14-15題]某生在恆溫下進行 \( Na_2S_2O_3 \) 水溶液的分解反應速率實驗,反應式如下所示:
\[S_2O_3^{2-}+2H^+\rightarrow SO_2+S+H_2O\]
… (實驗步驟與數據表同14題) …
15. 關於實驗結果與推論,下列敘述哪些正確?
(A) 此反應對S2O3²⁻而言為一級反應
(B) 看不清「X」標誌時,代表產生了0.5 mmol 的硫
(C) 看不清「X」標誌是由於產生的二氧化硫氣泡干擾
(D) 若將HCl 溶液濃度改為0.15 M 時,不會改變標誌消失的時間(t)
(E) 若固定反應總體積,並增加Na2S2O3溶液體積與減少蒸餾水體積,則標誌消失時間(t)將變小
114分科化學考科-16
[題組:第16-17題]甲烷(CH₄)是天然氣的主要成分,燃燒時可以產生1200-1800 K的高溫。右圖是CH₄與O₂的混合氣體燃燒時產生的火焰示意圖,其中Z軸標示了火焰的高度位置。以X=0、Z=0為起始點,完全燃燒時的火焰最高點為Z=1.0(cm),火焰高度按比例的相對值為Z=0.2、0.4……等,如圖所示。
科學家透過儀器分析,分別得到在X=0、Z=0至1.0位置的化學成分莫耳分率,結果如下圖所示。圖中O₂的莫耳分率數值範圍為0.72-0.92,而其他氣體的比例較少,莫耳分率數值範圍在0.0-0.20之間。
穩定的火焰中,下圖表示甲烷燃燒過程中的各氣體莫耳分率變化,可以呈現其燃燒的結果。
16. 關於此混合氣體燃燒實驗,下列敘述哪些正確?
(A)燃燒前混合氣體中CH₄與O₂的莫耳數比大於0.2
(B)燃燒前混合氣體中有H₂O及CO₂雜質
(C)燃燒過程共消耗掉約0.15莫耳的O₂
(D)完全燃燒後CH₄轉變生成CO₂與H₂O
(E)完全燃燒後產生之H₂O重量約為CO₂重量之2倍