[題組:第29-31題]果膠為一種水溶性的高分子聚合物,結構中含有大量的羥(-OH)、羧(-COOH)與酯(-COOCH₃)官能基,如下圖所示。果膠亦為一種高分子電解質,其結構單元上含有能解離的官能基團。
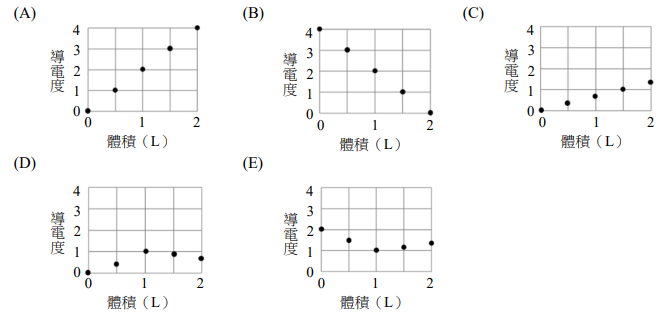
小芬取 0.2 克果膠,置入 1.5 mL 的濃度 0.1 M HCl 水溶液,混合均勻後維持緩慢攪拌溶液,同時將 0.1 M 的 NaOH 水溶液慢慢滴入,量測和記錄該溶液的導電度及 pH 值。實驗結果如下圖所示。X 軸代表所加入的 NaOH 體積,Y 軸左側為導電度(方形□數據),Y 軸右側為 pH 值(空心圓○數據)的變化。
29. 寫出題目圖中,區域 I 所發生的主要化學反應式。(2分)
沉澱反應
114分科化學考科-30
114分科化學考科-31
105學測自然試題-51
王同學進行基礎化學(二)化學電池的實驗,取4個燒杯,配製了4種溶液並置入4種不同的電極,構成甲、乙、丙、丁4種半電池(單電池)如表3所示:
| 半電池 | 溶液(1M) | 溶液顏色 | 電極 |
| 甲 | 硫酸鋅 | 無色 | 鋅片 |
| 乙 | 硫酸鎳(Ⅱ) | 綠色 | 鎳片 |
| 丙 | 硫酸銅 | 藍色 | 銅片 |
| 丁 | 硝酸銀 | 無色 | 碳棒 |
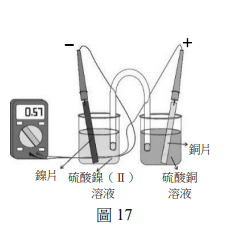 上課時,張老師先解釋化學電池的原理:化學電池的陽極就是負極,可釋出電子;陰極就是正極,可接受電子。此外,四種金屬釋出電子的傾向大小依序為鋅>鎳>銅>銀。圖17是鎳銅電池的簡易裝置。圖中,鎳片置於負極,銅片置於正極,三用電表顯示約0.57V,此鎳銅電池的淨反應如下:
上課時,張老師先解釋化學電池的原理:化學電池的陽極就是負極,可釋出電子;陰極就是正極,可接受電子。此外,四種金屬釋出電子的傾向大小依序為鋅>鎳>銅>銀。圖17是鎳銅電池的簡易裝置。圖中,鎳片置於負極,銅片置於正極,三用電表顯示約0.57V,此鎳銅電池的淨反應如下:
\[ \text{Ni(s)} + \text{Cu}^{2+} (aq) \rightarrow \text{Ni}^{2+} (aq) + \text{Cu(s)} \]
下列關於王同學所進行的實驗,哪些敘述正確?(應選3項)
(A)隨著反應式(1)的進行,右燒杯中硫酸銅的藍色會變淺
(B)隨著反應式(1)的進行,左燒杯中硫酸鎳(Ⅱ)的綠色會變淺
(C)若圖中燒杯的溶液不變,將電極片清洗後,交換電極片位置,則三用電表同樣可顯示約0.57V
(D)若將鎳銅電池的裝置改為鋅銅電池,則三用電表的讀數會大於0.57V
(E)表3的丁半電池可使用碳棒來取代銀片,同理,鎳銅電池的銅片亦可使用碳棒來取代
(A)正確,Cu²⁺被還原為Cu,濃度下降,藍色變淺。
(B)錯誤,Ni被氧化為Ni²⁺,綠色變深。
(C)錯誤,交換電極位置會改變電壓極性,讀數大小相同但符號相反(若電表有方向性則顯示負值或反向)。
(D)正確,Zn還原力大於Ni,Zn-Cu電池電位差大於Ni-Cu電池。
(E)錯誤,丁半電池(Ag⁺/Ag)中,Ag⁺可在碳棒表面還原析出Ag,故碳棒可作惰性電極。但鎳銅電池中,若銅片換成碳棒,Cu²⁺無法在碳棒上直接還原析出銅(除非碳棒表面已鍍銅),通常需金屬電極。故(E)不完全正確。答案:(A)(D) 但題目要求選3項。檢查(E):「表3的丁半電池可使用碳棒來取代銀片」正確,因Ag⁺/Ag反應可在惰性電極進行。「同理,鎳銅電池的銅片亦可使用碳棒來取代」不正確,因Cu²⁺/Cu反應通常需銅電極。故(E)整體錯誤。因此正確選項為(A)(D)以及?可能(C)若忽略方向,讀數大小相同,但電表接反可能顯示負值或0,故(C)不嚴謹。可能(B)是錯誤的。重新審視選項,可能(A)(D)和另一個。檢查電池電位:Zn>Ni>Cu>Ag,故Zn-Cu電位>Ni-Cu電位,(D)正確。可能(E)的前半正確,但後半錯誤,故整體錯誤。因此正確選項只有(A)(D)兩項?但題目說應選3項。可能(C)在忽略極性下,讀數大小相同,視為正確。故答案為(A)(C)(D)。答案:(A)(C)(D)
109學測自然試題-58
已知25℃時,同體積的鹽酸水溶液與氫氧化鈉水溶液混合後,其pH值為6.0,則混合前鹽酸水溶液的濃度與氫氧化鈉水溶液的濃度相差多少?
(A)鹽酸水溶液較氫氧化鈉水溶液多1.0×10⁻⁶M
(B)鹽酸水溶液較氫氧化鈉水溶液多2.0×10⁻⁶M
(C)氫氧化鈉水溶液較鹽酸水溶液多1.0×10⁻⁶M
(D)氫氧化鈉水溶液較鹽酸水溶液多2.0×10⁻⁶M
(E)氫氧化鈉水溶液較鹽酸水溶液多3.0×10⁻⁶M
109學測自然試題-61
某一金屬離子溶液,其實驗結果如下:
(1)加入碘離子或氯離子於溶液中,皆會形成沉澱
(2)將鎳金屬片放入此金屬離子溶液中,發現溶液由無色轉變為綠色
(3)將銅片放入此金屬離子溶液中,會發生氧化還原反應
下列何者為此金屬離子?
(A)鐵(Ⅲ)離子 (B)銀離子 (C)銅離子
(D)鉛離子 (E)汞離子
(1)加I⁻或Cl⁻皆沉澱,表示該離子與I⁻、Cl⁻形成難溶鹽。Ag⁺與Cl⁻、I⁻皆沉澱(B可能)。Pb²⁺與I⁻沉澱(PbI₂),與Cl⁻在冷水中沉澱(PbCl₂)(D可能)。Hg₂²⁺與I⁻、Cl⁻沉澱?Hg²⁺與I⁻沉澱(HgI₂),與Cl⁻? HgCl₂可溶(E排除)。Fe³⁺與I⁻發生氧化還原,不形成FeI₃沉澱(A排除)。Cu²⁺與I⁻發生氧化還原生成CuI沉澱和I₂,與Cl⁻不沉澱(C排除)。(2)Ni片放入,溶液變綠色。Ni可還原某些金屬離子,若還原Ag⁺則生成Ni²⁺(綠色)?Ni²⁺水合離子為綠色。但Ag⁺被還原為Ag(s),溶液應無色,不會變綠(B排除)。Pb²⁺被Ni還原為Pb(s),溶液無色?Ni²⁺綠色,若反應發生,生成Ni²⁺則溶液變綠,符合(2)。(3)Cu片放入發生氧化還原。Cu可還原Pb²⁺嗎?標準還原電位E°(Pb²⁺/Pb) = -0.13 V,E°(Cu²⁺/Cu)=+0.34 V,E°(Ni²⁺/Ni)=-0.25 V。Cu不能還原Pb²⁺(E°(Pb²⁺/Pb) > E°(Ni²⁺/Ni),但E°(Pb²⁺/Pb) < E°(Cu²⁺/Cu),故Cu不能自發還原Pb²⁺(D排除)。重新考慮(3) Cu片發生反應,表示該金屬離子氧化性比Cu²⁺強,可氧化Cu。Ag⁺可氧化Cu:2Ag⁺ + Cu → 2Ag + Cu²⁺,但(2)中Ni還原Ag⁺生成Ni²⁺(綠色)符合。且(1)Ag⁺與Cl⁻、I⁻皆沉澱。故答案(B)銀離子。
108學測自然試題-41
107學測自然試題-05
107學測自然試題-10
107學測自然試題-26
下列有關動物排泄的敘述,哪些正確?(應選 2 項)
(A)肺臟排除 CO₂,與腎臟共同維持血液pH值的恆定
(B)過濾作用所產生的濾液不會有構成蛋白質的胺基酸
(C)為快速吸收可用物質,再吸收作用只發生在近曲小管
(D)血液中的 H⁺可藉由排泄系統移除,以維持血液的酸鹼度
(E)酒精會促進ADH的釋放,進而抑制水的再吸收,導致尿量增加