二、取12.0mg的某一含碳、氫、氧的化合物甲,經完全燃燒後,得26.4mg的CO₂及14.4mg的H₂O。另取12.0g的甲,在1.0L的容器加熱,當完全氧化時,測得容器的溫度為127℃,壓力為6.56atm。
根據這些實驗結果,回答下列問題:
1. 寫出化合物甲的實驗式。
2. 寫出化合物甲的分子量。
3. 寫出化合物甲的分子式,並畫出化合物甲之所有可能的結構異構物。
燃燒分析
109學測自然試題-57
化學家在合成新的有機化合物後,會利用碳與氫的元素分析數據,來幫助化合物的鑑定。假設在鑑定一未知的有機化合物時,發現當 10.0 毫克的樣品完全燃燒後,其混合氣體可使無水過氯酸鎂管柱增加 10.8 毫克,並使氫氧化鈉管柱增加 26.4 毫克。試問下列哪一個化合物,最符合實驗所測量結果?
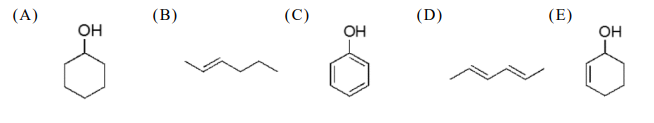
無水過氯酸鎂吸水,增重10.8 mg為H₂O質量,含H質量= (2/18)×10.8 = 1.2 mg。氫氧化鈉吸CO₂,增重26.4 mg為CO₂質量,含C質量= (12/44)×26.4 = 7.2 mg。樣品10.0 mg,故O質量=10.0 - 1.2 - 7.2 = 1.6 mg。C:H:O原子數比 = (7.2/12) : (1.2/1) : (1.6/16) = 0.6 : 1.2 : 0.1 = 6 : 12 : 1。最簡式C₆H₁₂O,分子量約100。比對選項結構式,符合C₆H₁₂O的為環己酮或己醛等。需看選項具體結構判斷。若選項中有一個是C₆H₁₂O,即為答案。
108學測自然試題-32
某生想利用圖 9 的燃燒分析實驗裝置,推導出某一值含碳、氫、氧三種元素化合物的實驗式。實驗中利用丙、丁兩支吸收管,其中一支填充過氯酸鎂(吸收水分),另一支填充氯化鈉(吸收二氧化碳)。稱量兩支吸收管燃燒前後重量差,即可分別算出生成的水及二氧化碳重量,進而求出各元素之重量百分率,最後求得實驗式。為了使未知化合物燃燒完全,通常需使用氧化銅。下列針對圖 9 的實驗裝置甲、乙、丙及丁處所應放置的物質及其功用的敘述,哪些正確?(應選 2 項)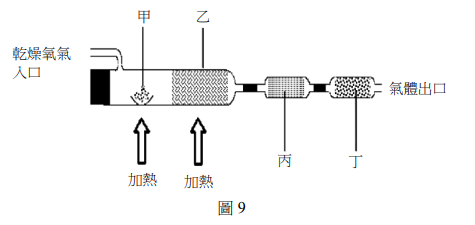
(A) 氧化銅應放於乙處
(B) 氧化銅為還原劑
(C) 過氯酸鎂應放於丁處
(D) 氫氧化鈉應放於丁處
(E) 實驗前後,需分別稱得氧化銅、過氯酸鎂及氫氧化鈉的重量,才能推算出碳、氫、氧三元素的重量
113學測自然試題-10
五種化合物的分子式分別是甲( \( C_{19}H_{19}N_2O_6 \) )、乙( \( C_{20}H_{30}O \) )、丙( \( C_{28}H_{44}O \) )、丁( \( C_6H_{8}O_6 \) )與戊( \( C_{29}H_{50}O_2 \) )。某化合物經完全燃燒後,所得二氧化碳與水重量比為11:3,則此化合物為下列哪一種?(原子量C=12.0,H=1.00,O=16.0)
(A)甲 (B)乙 (C)丙 (D)丁 (E)戊
