[題組:第8題到第9題]已知 OCl⁻ 及 HOCl 的標準還原電位表如下:
\( \text{HOCl + H}^+ + \text{e}^- \rightarrow \frac{1}{2} \text{Cl}_2 + \text{H}_2\text{O} \quad \text{E}^0 = +1.61 \, \text{V} \)
\( \text{OCl}^- + \text{H}_2\text{O} + 2 \text{e}^- \rightarrow \text{Cl}^- + 2 \, \text{OH}^- \quad \text{E}^0 = +0.81 \, \text{V} \)
下列有關 Cl₂、NaOCl 及 HOCl 的敘述,何者正確?
(A) HOCl 的 $pK_a$ 值約為 7.5
(B) NaOCl 可用於洗手消毒
(C) HOCl 及 NaOCl 均為鹼性化合物
(D) 相同濃度的溶液,HOCl 比 NaOCl 還原力強
(E) NaOCl 的溶液在低於 pH 5 的條件下,會有 Cl₂ 產生
電化學
答案
110指考化學考科-10
王同學欲進行化學電池實驗,查出4種半電池標準還原電位,如表1所示,並取得相關的鈍水、鹽橋、燒杯、鹽類及電極。王同學取出兩種半電池,並以鹽橋連結組合後,構成化學電池,如圖3所示。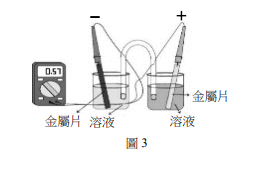
表1
| 還原半電池電位 | 鹽類 | 電極 |
| Zn²⁺ E⁰ = -0.76 V | 硝酸銨 | 銨片 |
| Ni²⁺ E⁰ = -0.23 V | 硝酸鎳 | 鎳片 |
| Pb²⁺ E⁰ = -0.13 V | 硝酸鉛 | 鉛片 |
| Cu²⁺ E⁰ = 0.34 V | 硝酸銅 | 銅片 |
下列實驗條件及其結果的敘述,何者正確?
(A)測得電壓為0.57V的電池中,銅片為正極
(B)鎳銨電池中,鎳片為陽極
(C)鎳鉛電池所測得電壓會大於0.36V
(D)將鹽橋移除改用銅線,仍可組成電池
(E)將半電池的金屬換成石墨,仍可組成電池
答案
110指考化學考科-27
三、丹麥今年啟動了氮氣工業生產的綠色程序,使用固態氣離子電解槽(SOEC),過程中不需要高成本的空氣分離,圖9為其裝置示意圖。將適當比例的空氣和水蒸氣通入陰極,兩者均進行電解,氧氣生成O²⁻,水蒸氣產生H₂和O²⁻。氣離子薄膜只允許氧離子(O²⁻)通過,並在陽極反應。已知SOEC電解水的效率可達80%,在通入莫耳數比為1:3的空氣和水蒸氣後,經電解生成甲和乙兩部分的氣體。甲含有未反應的水蒸氣,將甲通過除水裝置後,直接導入哈柏法製程,即可製造氨。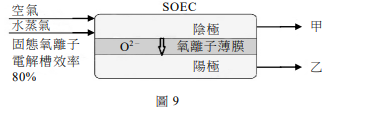
根據這些實驗結果,回答下列問題:
1. 寫出甲部分的氣體中,除了水蒸氣外,所含兩種主要氣體的化學式。
2. 寫出兩種在實驗室中用於吸收水蒸氣的常用化合物的化學式。
3. 寫出陽極的係數平衡電化學半反應式。
4. 已知SOEC電解水的效率可達80%。由化學計量的觀點,說明在此效率下,需要通入莫耳數比為1:3的空氣和水蒸氣的原因。
答案
